DNA çift sarmalı sanat galerilerinden ticari amblemlere kadar temsil edilen modern bir biyoloji simgesidir. Basitçe ifade edilirse, DNA, her insan için benzersiz genetik kod içeren uzun bir moleküldür. DNA, ebeveynlerden çocuklara aktarılan kalıtsal bilgileri taşır ve işleyen hücreleri, dokuları ve organizmaları inşa etmek ve sürdürmek için gereken birçok proteinin nasıl (ve ne zaman) yapılacağına dair talimatlar sağlar.
James Watson ve Francis Crik, 1953’te DNA’nın yapısı için çift sarmal modelini önermişlerdir. James Watson ve Francis Crick keşifleri, bir dereceye kadar, Maurice Wilkins laboratuarında çalışan Rosalin Franklin’in gerçekleştirdiği X ışınları kırınımına dayanmaktadır.

Çift sarmal, temel moleküler biyolojinin başlangıç noktasını oluşturur.
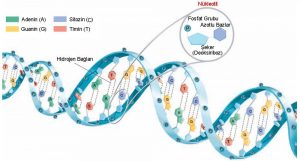
Kimyasal anlamda DNA, nükleotit denilen yapı taşlarından oluşan bir zincirdir. Her nükleotit bir şeker, bir fosfat ve bir bazdan -adenin(A), guanin(G), sitozin(C), timin(T)- oluşur.
PRİMER YAPI: Nükleik Asitlerin Bileşenleri
Nükleik asitler için günümüzde kullanılan kısaltmalar, DNA ve RNA’dır. Fakat bu kısaltmalar evrensel kabul görünmeden önce söz konusu moleküller için birçok farklı isim kullanıldı. Örneğin, DNA ilk olarak sığır timus bezinden izole edildiği için , timus nükleik asiti, RNA ise maya’dan izole edildiği için, maya nükleik asiti olarak isimlendirilmiştir. DNA ve RNA moleküllerinin yapısındaki nükleotit dizileri primer yapı olarak bilinir. Nükleik asitler, nükleotitler denilen alt birimlerin oluşturduğu polimerler veya uzun zincirlerdir. Her bir nükleotit alt birimi 1 adet 5 karbonlu şeker, 1 adet fosfat grubu, 1 adet azotlu baz olmak üzere üç kısımdan oluşur.
Beş Karbonlu Şekerler
DNA’nın nükleotit alt birimleri, deoksiriboz şekeri içerirken, RNA’nın nükleotit alt birimleri riboz olarak isimlendirilen pentoz(5 Karbonlu) şekeri içerir. DNA ve RNA arasındaki bu küçük fark görevlerini önemli ölçüde etkiler. Her bir pentoz şekerindeki beş karbon atomu 1’ (üssün)’ den 5’ (üssü)’ne kadar numaralaral işaretlenir. Üsler, şeker halkalarındaki numaralandırmayı baz halkalarındaki numaralandırmadan ayırmak için kullanılır. Beş üyeli halkanın bir üyesi olarak, her iki şekerde de birer oksijen vardır, yani oksijen halkanın bir üyesidir. 5’ karbon halkanın dışındadır.

Azotlu Bazlar
İsimlerinden de anlaşılabileceği gibi, azotlu bazlar, bir bazın kimyasal özelliklerine sahip olan, azot içeren moleküllerdir( baz, çözeltide bir H+ iyonu veya proton alan madde ). Bazların ikisi [adenin(A) ve guanin (G)—pürinler olarak isimlendirilir. Ve çift karbon —azot halka yapısına sahiptir. Diğer 3 baz [timin(T), sitozin(C) ve urasil (U) — ise tek halkalıdır ve pirimidinler olarak isimlendirirler. Timin, sadece DNA’da bulunurken, urasil RNA’ya özeldir.

Watson ve Crick’in, 3 boyutlu DNA yapısını önermelerinden birkaç yıl önce, Ervin Chargaff DNA’daki her bir bazın miktarını belirlemek için, kağıt kromotografisi yöntemini geliştirdi. Chagaff farklı bazların molar konsantrasyonları arasında belirli düzenli ilişkiler gözlemledi. Bu ilişkiler günümüzde Chargaff Kuralları olarak isimlendirilir. Chargaff tüm DNA örneklerinde A bazlarının sayısının T bazlarının sayısına eşit olduğunu gösterdi; yani [A]=[T], bazın molar konsantrasyonu, köşeli parantez içinde bazın sembolü ile gösterilmiştir. Bundan dolayı, G bazlarının sayısı da C’ ninkine eşittir: [G]=[C]. Sonuç olarak pürin bazlarının miktarı pirimidin bazlarınınkine eşittir: [A]+[G]=[T]+[C]. Chargaff aynı zamanda ‘yüzde G+C’’ olarak tanımladığı DNA’ nın baz kompozisyonunun türler arasında değiştiğini fakat tür içindeki bir organizmanın tüm hücrelerinde sabit olduğunu keşfetti. Yüzde G+C içeriği organizmaya bağlı olarak %22 ile %73 arasında değişebilir.
Fonksiyonel fosfat grubu
Fonksiyonel fosfat grubu (PO4), DNA ve RNA’ya, fizyolojik pH’da asit (bir çözeltide H+ veya proton salıveren madde) özelliği verir. Bundan dolayı ‘‘nükleik asit’’ denir. Fosfatlardan oluşan bağlar kararlı olmalarına rağmen yine de enzimatik hidroliz ile kolayca kırılan esterlerdir. Bir nükleotit DNA veya RNA zincirinden ayrıldığında nükleotit süreç içinde yok edilmez. Dahası, fosfodiester bağları oluştuktan sonra , fosfat grubunun bir oksijen atomu hala negatif olarak iyonizedir. Negatif yüklü fosfatların yağlardaki çözünürlüğü son derece düşüktür. Ökaryotik hücrelerin çekirdeğini veya bir hücreyi çevreleyen zarıN içeriğini bir an düşünün. Bütün canlılarda fosfolipidler hücre zarlarının önemli bileşenlerdir. Bu nedenle nükleik asitlerin yağlarda çözünmezliği, onların hücre içinde tutulmasını garanti eder.

DNA ve RNA Zincirlerinin Uzunluğu
Baz çifti(bp) sayısı, çift zincirli DNA’nın uzunluk ölçüsü olarak kullanılır. Pratikte DNA için kullanılan uzunluk birimi 1000 baz çiftine karşılık gelen kilobaz çifti (kb veya kbp) veya 1,000,000 baz çiftine karşılık gelen megabaz çifti(Mb veya Mbp)’dir. Araştırmacılar laboratuarda genellikle 50 bazdan daha kısa olan ve oligonükleotitler olarak adlandırılan tek zincirli DNA parçalarından yararlanırlar.
5’ ve 3’ önemi
Nükleotitin asimetrik yapısı sebebiyle, bir DNA veya RNA zincirini oluşturmak için birbirine bağlanan nükleotitler, belli bir polarite oluştururlar. Nükleotit zincirinin uçlarından biri 5’, diğeri 3’ sembolü ile belirtilir. 5’ sembolü, fonksiyonel fosfat (PO4 ) grubunun bağlı olduğu şekerdeki karbonu belli eder. 3’ sembolü, fonksiyonel hidroksil (OH) grubunun bağlı olduğu şeker halkasındaki karbonu ifade eder.

DNA’nın SEKONDER YAPISI
Watson ve Crick’in ortaya çıkardığı gibi DNA genellikle hücrede birbirine sarılan çift zincir olarak yer alır. Çift zincirli DNA(dsDNA) veya dubleks DNA olarak da farklıdır. DNA çift sarmalı, bazı virüslerde bulunan tek zincirli DNA (ssDNA)’dan farklıdır. DNA’nın yapısı, organizmaların üreme ve gelişmesi için gerekli olan genetik bilgiyi çoğaltmalarına ve muhafaza etmelerine izin verir. Çeşitli zayıf kimyasal kuvvetler, DNA çift sarmalının oluşumunu sağlar. Bunlar bazlar arasındaki hidrojen bağları ile bazların kümeleşmesine yol açan hidrofobik etkileşimleri içerir.
Bazlar arasında hidrojen bağları oluşur
Termodinamik olarak kararlı hidrojen bağları, birbirine sarılan DNA zincirlerinin karşılıklı zincirlerindeki azotlu bazlar arasında oluşur. Hidrojen bağları, bir hidrojen atomunun, oksijen ve azot gibi elektronegatif atom arasında paylaşılmasını gerektiren çok zayıf bağlardır. Hidrojen bağları, zincirleri bir arada tutan bir tür güçtür. Hidrojen bağları tek tek çok zayıf olmalarına rağmen çok sayıda bulunduklarında moleküle yapısal bir kararlılık verirler. Çift zincirli DNA, çok sayıda bu zayıf bağlardan içerir. Termal hareket daima her bir zincirinin uçlarına yakın baz çiftlerini birbirinden ayırsa bile, diğer hidrojen bağları hala sağlam olduğundan, iki zincir genellikle birbirinden ayrılmaz. Bir bağ kırılır kırılmaz, fizyolojik şartlar altındaki en muhtemel olay ek bağların kırılmasından ziyade aynı hidrojen bağlarının yeniden oluşmasıdır.
Baz İstiflenmesi, DNA çift sarmalına kimyasal kararlılık sağlar
Hücresel yaşamın moleküler süreçleri genellikle sulu çözeltilerde gerçekleşmektedir ve hücre içi bileşenler suda kolayca çözülebilen oldukça büyük moleküllerdir. Azotlu bazlar kutupsuz (apolar) ve bu nedenle hidrofobik ‘‘su sevmez’’ oldukları için bir istisnadır. Kendi başlarına, pratikte, hücrelerin sulu ortamında çözünmezler. Polar su molekülü üzerindeki yüklerin asimetrik dağılımı, DNA’nın yapısı için önemlidir. Bazlar, nükleotit oluşturmak üzere, bir şekere ve bir fosfata kovalent olarak bağlandığında, suda çözünebilir hale gelirler fakat yine de çözünmezlikleri hala çözeltideki DNA’nın tam konformasyonu üzerinde büyük sınırlanmalara sebep olur. Eşleşmiş, nispeten yassı bazlar sarmal dönüş sebebiyle birbirlerinin üzerime istiflenme, raflaşma, yığılma eğilimindedirler. Çift zincirli DNA’nın bu özelliği ‘‘baz istiflenmesi’’ olarak bilinir. Bu istiflenme, bazlar arasındaki herhangi bir boşluğu ortadan kaldırır ve çift sarmalın içerisinden büyük miktarda suyu dışarı çıkarttır.
Bu etkileşimler gerçekte zayıf van der Waals etkileşimlerinin bir örneği olmasına rağmen, suyun güçlü bir şekilde polar olmayan grupları dışarıda tutma eğilimi sıklıkla ‘‘hidrofobik bağ’’ olarak ifade edilir. Hidrofobik bazlar birbirlerine yakınlaştıklarında, atomlar arasındaki spesifik olmayan elektriksel çekimler sayesinde kararlı hale gelirler. Bu zayıf çekimler oluşurü çünkü elektronların sürekli hareketi, atomlarda yük açısından zamanla değişen küçük bir asimetriye sebep olur. Bazlar birbirine çok yaklaşınca, bir bazdaki küçük kısmi yük yanındaki yük yanındaki diğer bazdaki zıt kısmi yükü uyarır ve bir çekime neden olur. Çekim, kovalent bağlara hatta hidrojen bağlarına göre zayıf olmakla birlikte, çok sayıdaki van der Waals etkileşimleri, DNA çift sarmalı gibi yapıların kararlılığını önemli derecede arttırabilir.
DNA’nın TERSİYER YAPISI
Uzun DNA moleküllerinin birkaç dönüş veya ‘‘kıvrım’’ kazanması veya kaybetmesi nispeten kolaydır. Bu durum, DNA replikasyonu veya bazı proteinlerin DNA’ya bağlanması sırasında, DNA’nın yer yer açılmasıyla meydana gelebilir. DNA’nın iki ucu dönmek için serbest değilse, dönüş sayısınındaki küçük, DNA’nın düz bir yol izlemektense aşırı sarmallaşmasına neden olur. Örneğin, çoğu doğal DNA serbest 5’ ya da 3’ uçları olmaksızın dairesel yapıdadır. DNA çift sarmalındaki zincirlerin polaritesinden dolayı, bir zincirin 5’ ucu sadece kendi 3’ ucuna bağlanabilir ve kovalent olarak kapalı bir halka oluşturur. Bu yüzden, dairesel çift zincirli DNA, birbiri etrafında dönen tek zincirli iki halkadan oluşur. Bunun gibi dairesel DNA molekülleri, DNA çift sarmalındaki tam dönüşünün sayısına göre çoğu kez aşırı sarmallıdır. Bu DNA, daha sonra (burulma stresi altında) süper sarmal haline gelebilir. Süpersarmal, burulmuş, enerjetik olarak daha avantajlı üç boyutlu bir yapıdır.






Yorum ekle